
2020年12月30日已經提交註冊、距離科創板上市一步之遙的杭州安旭生物科技股份有限公司(下稱“安旭生物”),1月15日被國家藥監局公開通報臨床試驗數據存在真實性問題。國家藥監局責成浙江省藥監局依法依規調查處理。調查處理結果報國家藥品監督管理局。
安旭生物董秘辦方面迴應《華夏時報》記者稱,臨床試驗數據主要問題是出在委託的醫療機構身上,企業也是受害者。
根據國家藥監局的通報披露,為安旭生物此次醫療器械註冊申請項目開展臨床試驗的是浙江大學醫學院附屬第一醫院(下稱“浙一”)。醫院方面向《華夏時報》記者表示,對此事不清楚,“你應該去問藥監局”。
唯一抽檢出問題的數據
根據國家藥監局官網1月15日發佈的“國家藥監局關於2020年醫療器械臨床試驗監督抽查中真實性問題的公告(2021年第11號)”,國家藥監局於2020年11月,對在審的10個醫療器械註冊申請項目開展了臨床試驗監督抽查,涉及27家臨床試驗機構。
抽查的結果是,杭州安旭生物科技股份有限公司生產的人類免疫缺陷病毒抗體/丙型肝炎病毒抗體/乙型肝炎病毒表面抗原/梅毒螺旋體抗體聯合檢測試劑盒(免疫層析法)(受理號:CSZ2000162)在浙江大學醫學院附屬第一醫院開展臨床試驗中,醫療機構留檔的電子照片拍攝時間、地點與臨床試驗實際時間、地點不一致,臨床試驗數據無法溯源。
國家藥監局決定根據《中華人民共和國行政許可法》第七十八條和《體外診斷試劑註冊管理辦法》第四十九條規定,對該註冊申請項目不予註冊,並自不予註冊之日起一年內不予再次受理該項目的註冊申請。同時責成浙江省藥品監督管理局切實履行對杭州安旭生物科技股份有限公司和相關臨床試驗機構的屬地監管責任,依法依規調查處理。調查處理結果報國家藥品監督管理局。
國家藥監局還在通報中提到,申辦者和臨床試驗機構應當嚴格按照《醫療器械臨床試驗質量管理規範》要求開展臨床試驗,切實落實主體責任,確保臨床試驗過程科學規範、結果真實可靠。各省級的藥監部門也要高度重視對醫療器械臨床試驗的監督管理,採取有效措施,加強對本轄區內申辦者和臨床試驗機構的監管。
安旭生物方面向《華夏時報》記者強調,國家藥監局在通報中說得很明確,臨床數據有問題是醫院留檔的照片對不上,並非企業自身的問題。至於是否會對上市造成影響,和醫院的責任認定以及是否還會繼續合作等,企業稱目前是靜默期不方便多說,等浙江省藥監局的調查結果出來。若說現成的影響,那就是被抽查到的註冊申請項目停一年再申請。
有業內人士向《華夏時報》記者表示,臨床試驗數據的真實性問題就是真假問題。“如果數據沒有被企業採信,就是醫院的責任,如果企業應用了這個不合格的數據,企業就要承擔責任。”
之前也有自媒體稱,此次臨床數據被抽查到問題是源自企業內部舉報,安旭生物予以了否認。
體外診斷產品供應商
根據上交所官網的信息,2020年6月2日,安旭生物科創板上市申請獲受理,2020年7月1日已問詢,隨後在2020年11月3日順利通過上市委會議,2020年12月30日提交註冊,目前正在等待註冊結果。
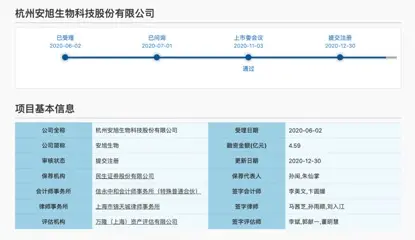
根據安旭生物2020年12月30日披露的招股書(註冊稿),企業成立於2008年7月4日,總部位於浙江杭州。專注於POCT試劑及儀器的研發、生產與銷售,擁有抗原抗體自主研發生產的生物原料技術平臺,以及成熟的免疫層析及乾式生化診斷技術平臺,發展形成了覆蓋毒品檢測、傳染病檢測、慢性病檢測、妊娠檢測、腫瘤檢測、心肌檢測、生化檢測、過敏原檢測等八大領域的POCT試劑,產品遠銷美國、德國、英國、加拿大、俄羅斯、墨西哥、泰國、印尼及波蘭等多個國家,已成為國內少數幾家在POCT國際市場能夠與跨國體外診斷行業巨頭競爭的中國體外診斷產品供應商之一。
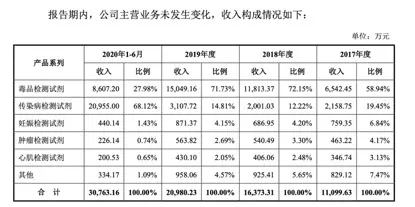
安旭生物的產品系列主要分為毒品檢測試劑、傳染病檢測試劑、妊娠檢測試劑、腫瘤檢測試劑、心肌檢測試劑和其他六大類。此次被國家藥監局抽檢到數據存在問題的人類免疫缺陷病毒抗體/丙型肝炎病毒抗體/乙型肝炎病毒表面抗原/梅毒螺旋體抗體聯合檢測試劑盒,就屬於安旭生物的傳染病檢測系列。
2017年-2019年,安旭生物的傳染病檢測試劑分別實現營收2158.75萬元、2001.03萬元、3107.72萬元,佔比分別為19.45%、12.22%、14.81%。
2020年1-6月,安旭生物的傳染病檢測試劑營收增長至20955萬元,佔比68.12%。
臨上市之前被抽檢到臨床數據真實性的問題,業內有觀點認為對於IPO會產生影響。醫藥行業觀察人士、醫藥專業媒體藥聞社主編張亮認為,目前藥監局飛行檢查制度非常常態化,是否源自內部人舉報不能妄下結論,但臨床數據真實性存疑會影響到企業的新藥審批。而企業稱問題出在醫院,“關鍵是如何自證清白”?
上海漢聯律師事務所宋一欣律師接受《華夏時報》記者採訪時表示,表面上來看企業沒有責任,但此事應該及時準確披露,如果不披露,就要承擔責任。
責任編輯:徐芸茜 主編:公培佳
轉載請超鏈接註明:頭條資訊 » 國家藥監局通報臨床數據真實性存疑,上市在即安旭生物遭醫院“挖坑”?
免責聲明
:非本網註明原創的信息,皆為程序自動獲取互聯網,目的在於傳遞更多信息,並不代表本網贊同其觀點和對其真實性負責;如此頁面有侵犯到您的權益,請給站長發送郵件,並提供相關證明(版權證明、身份證正反面、侵權鏈接),站長將在收到郵件24小時內刪除。