紅週刊 記者 | 陳秋
允許虧損上市的科創板,又有新的處於研發階段的公司獲得上交所受理。海和藥物招股書顯示,公司有多項產品在研,有些產品可能在未來幾年上市。
那麼,海和藥物能否邁過君實生物在科創板上市即輝煌的窘境嗎?又或者更糟?對此,上海證券首席投資顧問付少琪對記者表示,“海和藥物尋求科創板上市,可以獲得資金加持,但這也在給投資者出難題,在研發期間上市,上市後股價狂跌或破發是有可能的。”

運營資金主要依賴外部融資
2月3日,上交所網站顯示,上海海和藥物研究開發股份有限公司(下稱“海和藥物”)科創板獲得受理,公司擬募資31.5億元。這是一家主營業務為抗腫瘤創新藥物發現、開發、生產和商業化的公司。本次發行募集資金扣除發行費用後,將投入新藥研發項目、泰州生產基地建設項目以及補充流動資金。
據海和藥物的招股書顯示,2017年、2018年、2019年和2020年1-9月,公司歸屬於母公司股東的淨利潤分別約為-1.73億元、-4.28億元、-2.93億元和-4.28億元。截至2020年9月30日,公司累計未分配利潤為-4.74億元。
上述情況主要是由於海和藥物目前仍無產品進入商業化階段,尚未形成產品銷售收入。但新藥研發需要大量持續的研發投入,由此導致公司虧損並存在大額累計未彌補虧損。
海和藥物還稱,公司將在發現新產品、推動在研藥品的臨床開發及商業化等諸多方面繼續投入大量資金,需要通過各類融資渠道獲取資金。截至本招股說明書籤署日,公司營運資金主要依賴於外部融資。
報告期內,海和藥物獲得了多項政府補助。2017年、2018年、2019年和2020年1-9月,公司的政府補助金額分別為204.74萬元、690.14萬元、1533.00萬元、470.93萬元。
對於政府補助,海和藥物在報告中提醒,政府有關部門可能會因政策變化而決定減少或取消政府補助,公司無法保證政府補助的持續性。若未來相關政策有所調整或公司無法滿足相關條件,公司將面臨政府補助減少的風險,從而將會對公司未來經營產生不利影響。
此外,根據天眼查APP數據顯示,2019年2月,海和藥物宣佈完成由華蓋資本領投的1.466億美元融資;2020年6月,海和藥物完成新一輪股權融資,投資方為南江三正健康、貴景資本、上海創世盤古,具體融資金額未披露;而僅隔一個月,2020年7月,海和藥物再次披露由華平投資領投的12億元B輪融資。在幾輪融資中,包括高瓴資本、盈科資本、君聯資本、中金資本、招銀國際資本等參與其中。
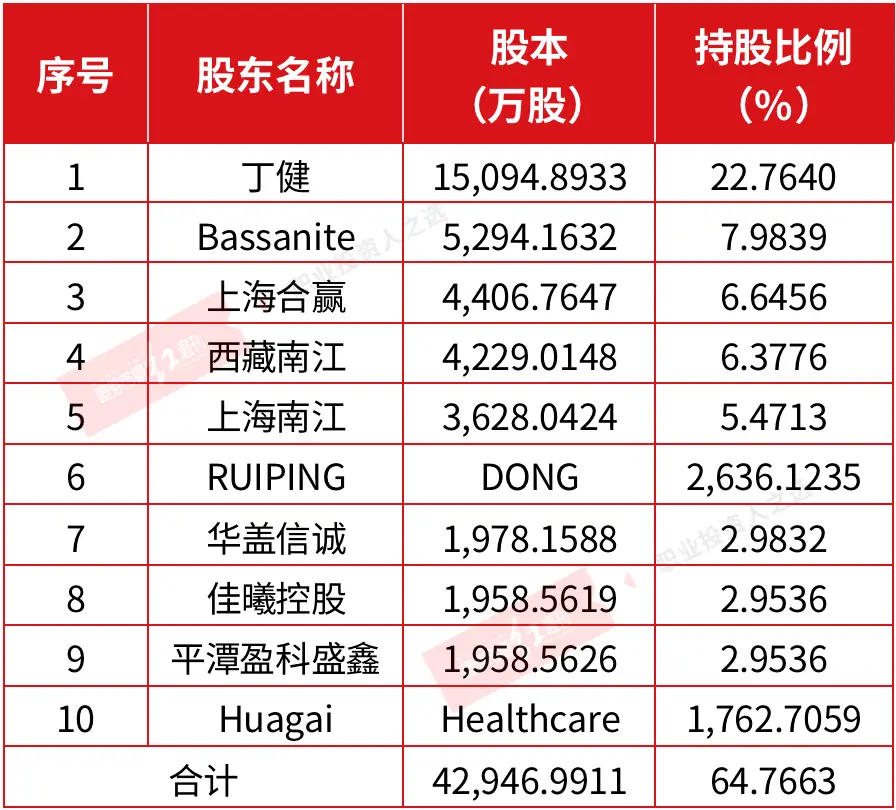
截至招股說明書籤署日,海和藥物股東共計48名,控股股東、實際控制人為丁健。據悉,丁健直接持有海和藥物22.7640%股權,通過海和藥物員工持股平臺上海合贏間接控制海和藥物6.6456%股權,丁健直接及間接合計擁有海和藥物表決權的比例為29.4096%。其他持有公司5%以上股份的股東,包括Bassanite、西藏南江以及上海南江。(見附表)
附表 在此次發行前,海和藥物前十名股東持股情況
無獨有偶,百濟神州也在向科創板衝刺,需要靠融資不斷輸血。據招股書顯示,該公司擬募資200億元,投向藥物臨床試驗研發等項目。據悉,百濟神州累計融資額超300億元,但2017年-2019年,百濟神州累計虧損額達126.57億元。
產品商業化存不確定性
據記者查看招股書,目前海和藥物抗腫瘤創新藥產品管線涵蓋VEGFR、FGFR、PDGFR、c-MET、PI3Kα、ERK1/2、EZH1/2、AXL、BRD4等熱門靶點和信號通路。截至本招股說明書籤署日,公司主要在研產品共涉及9個化合物,其中7個化合物處於臨床研究階段,2個化合物處於臨床前研究階段。
但所有產品目前尚處於研發階段,尚未實現藥品銷售收入。其中,RMX3001(口服紫杉醇)、ON101處於III期臨床試驗階段(發行人未來並不持有RMX3001、ON101的上市許可證書,但享有商業化權益),德立替尼、谷美替尼是公司最接近上市許可的在研產品。
對於研發技術的產業化情況,招股書中顯示,RMX3001、AL3810(德立替尼)及SCC244(谷美替尼)項目推進相對較快,預計RMX3001項目於2022年初提交胃癌適應症的註冊申請,2022年底或2023年初提交乳腺癌適應症的註冊申請,胃癌適應症預計於2023年初獲批上市銷售。預計AL3810項目於2021年第三季度提交胸腺癌適應症的註冊申請,SCC244項目於2021年第四季度提交具有c-MET第14號外顯子跳變的非小細胞肺癌適應症的註冊申請,兩個產品預計均於2022年獲得批準實現上市銷售。
據悉,新藥研發是一項耗時耗資都非常龐大的系統工程,完成前期的基礎研究(藥理、毒理、藥效等動物研究)後開始申請進入人體臨床試驗階段。臨床試驗的週期,也就是臨床試驗的期別(I、II、III、IV期)。
值得注意的是,臨床試驗週期,II期是屬於相對前期的階段,能夠從II期順利進入III期的項目並不多,III期週期是最長的。在全世界範圍內,臨床試驗到達III期的項目成功率很低,且III期臨床實驗合格最終轉化到臨床應用,推向市場的成功率則更低。
相比之下,科創板上市A+H股公司,一度被市場寄予厚望的千億醫藥“巨頭”君實生物,實力則更強。資料顯示,君實生物是一家創新驅動型生物製藥公司,核心產品是特瑞普利單抗注射液(商品名:拓益),其2018年12月17日獲國家藥監局批準上市銷售,這是中國首個獲批的國產抗PD-1單抗。
但即便如此,2020年7月,君實生物在科創板上市後,也不免上市即是巔峰的處境。
(文中提及個股僅為舉例分析,不做買賣建議。)
轉載請超鏈接註明:頭條資訊 » 聚焦IPO|虧損的海和藥物衝擊科創板,產品商業化難題能否破解?
免責聲明
:非本網註明原創的信息,皆為程序自動獲取互聯網,目的在於傳遞更多信息,並不代表本網贊同其觀點和對其真實性負責;如此頁面有侵犯到您的權益,請給站長發送郵件,並提供相關證明(版權證明、身份證正反面、侵權鏈接),站長將在收到郵件24小時內刪除。