11月12日,某自媒體發表文章,直指君實生物(688180.SH;01877.HK)的某一款藥物存在問題,而且稱該公司的研發實力等有待考證,“研發團隊大專生多過博士”。
這麼一篇自媒體文章,不僅讓君實生物收到了監管機構的問詢函,而且從12日開盤到13日收盤,以A股的跌幅進行計算,它的總市值蒸發了約68.89億元。
11月13日深夜,君實生物發佈近萬字的長文公告,回覆了監管機構的問詢函,對自媒體質疑的一些問題進行了迴應。而對於其中一項較為關鍵的指控,它卻避而不談。
三大疑點,一一回應
疑點一:大專生多過博士?
確實如此,大專學歷員工未直接參與核心研發
11月12日,某自媒體發表文章稱,在君實生物的研發團隊中,大專生多過博士生,還有一大半都是本科畢業生。
11月13日深夜,在君實生物發佈的公告中,也對該質疑進行了詳盡的迴應。截至11月12日,君實生物共有員工2326人,其中研發人員為620人。
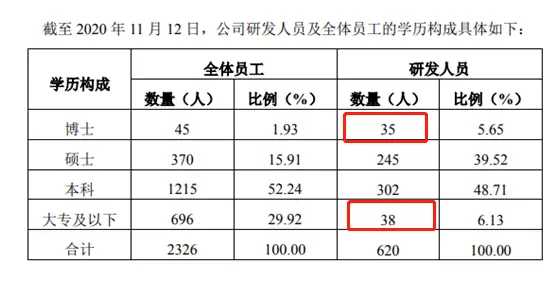
截圖自君實生物回覆函
在這620名研發人員中,有35人的學歷是博士,38人的學歷為大專,也就是說大專學歷的研發人員的確多於博士學歷的研發人員。
不過,君實生物在公告中稱,大專學歷的38人大多都是做研究工作的配合和支持工作,暫未直接參與核心的研發活動。
某藥物研發公司的研發人員告訴紅星資本局,現在藥物研發的學歷最低底線多是本科,大專的很少。但在藥物研發的過程中,大專學歷的人員也會承擔一部分工作。
“細說起來比較多。像藥理毒理,一般就是對動物進行實驗,初步驗證藥物的安全性和藥效性。還有一部分是臨床研究,研究後取得相關批件後在醫院開展的工作。”上述人士稱,一般情況下大專生不會到核心工作崗位。
在君實生物的研發團隊中,有302人是本科學歷,佔研發人員的48.71%,可以說是它的中堅力量;還有245人是碩士學歷,佔研發人員的38.52%,僅次於本科學歷的數量。
同時,紅星資本局注意到:過去,君實生物認定的核心技術人員僅4人,分別是馮輝、張卓兵、SHENG YAO(姚盛)和HAI WU(武海)。
在上個月,君實生物的“首席科學家”武海因個人原因離職,核心技術人員也從4人變成3人。
對此,君實生物迴應稱,武海的離職不會影響在研項目及核心技術的推進與實施,也不影響公司專利權的完整性。

圖據君實生物官網,其尚未撤掉關於武海的介紹
疑點二:不良反應發生率高達97.7%
迴應:3-4級不良反應發生率非常低
目前,君實生物只有這一款藥正式上市銷售。這款藥物——PD-1特瑞普利單抗注射液(拓益),是國內首個獲批上市的國產PD-1單克隆抗體注射液,常用於治療晚期黑色素瘤。
公開資料顯示:這款藥物(以下均簡稱“特瑞普利單抗”)每盒內有1瓶240mg(6ml)的藥物,價格為7200元。患者每2周靜脈輸注一次,每月在該藥上的花費超過1.4萬元。
圖據君實生物招股書
這一次,來自自媒體的質疑文章也將主力炮火對準了這款藥物。文章稱,這一款藥物的所有不良反應發生率為97.7%,有15.6%的患者因為不良反應而永久停藥。
紅星資本局在國家藥品監督管局藥品審評中心網站查詢發現,在該藥物的《申請上市技術審評報告》中,的確有上述數據。
對此,君實生物迴應稱,在所有不良反應發生率中,更受臨床醫生關注的是3級及以上不良反應發生率、與藥物相關的嚴重不良反應(SAE)發生率。
“(這一研究的)3-4 級不良反應發生率非常低。”君實生物在公告中稱,其他1-2 級(輕微)不良反應主要包括皮疹、乏力、食慾下降、 噁心、咳嗽和頭暈等。
前述某藥物研發公司的研發人員告訴紅星資本局,一般來說,所有藥物都會有不良反應,說明書中都會列舉出來。少數中藥的說明書中會寫“尚未知(不良反應)”。
“目前,沒有明文規定說‘不良反應發生率必須低於多少才能上市’,沒有這樣的警戒線。”上述研發人員稱。
四川大學某藥學專業研究人士向紅星資本局表示,“‘所有不良反應發生率’雖然看著高,但實際上同類型藥物都高。如果不良反應大多是輕度或中度,對一款救命的抗癌藥物來說,我覺得是完全可以接受的。”
疑點三:禮來製藥放棄了JS016S?
迴應:合作一切順利,停止實驗不涉JS016
君實生物的招股書顯示:它和中國科學院微生物研究所合作開發新型冠狀病毒中和抗體——JS016,目前項目處於早期開發階段。
今年5月,君實生物和美國的禮來製藥簽署協議,將在中國之外對JS016開展研發活動、生產和銷售的獨佔許可授予了禮來製藥。
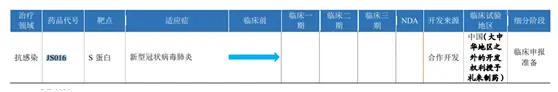
圖據其招股書。
對此,該自媒體在文章中質疑,禮來在美國開展了兩批新冠抗體臨床實驗。一批是自家研發的555抗體單用,一批是555+JS016的聯合用藥。其中一項涉“555”的實驗已經停止臨床研究,“JS016在美國上市之路已經大概率胎死腹中了。”
對此,君實生物迴應稱,JS016在國內外的臨床進展以及該項目和禮來製藥的合作均一切順利,不存在應披露而未披露事宜。
“截至本回復簽署日,JS016已順利完成中國、美國2項健康受試者I期研究。”君實生物稱。
同時,據君實生物介紹,禮來製藥停止的臨床試驗不涉及其產品 JS016,涉及的是禮來製藥的另一箇中和抗體 LY-CoV555。
這些疑點,避而不談
這對父子是外行領導內行?
紅星資本局注意到,君實生物在對上述三大疑點進行了一一回應後,卻對一些較為關鍵的指控避而不談。
比如,在該自媒體的文章中,零零散散地拋出了君實生物實控人父子(熊鳳祥和熊俊)的背景,暗指其是通過人際關係使新藥快速過審。
不過,紅星資本局在國家藥品監督管局藥品審評中心網站查詢發現,特瑞普利單抗能快速獲批上市,是由於其是“有條件獲批上市”。
有某上市制藥公司的員工告訴紅星資本局,一般來說,藥品研發申報都要經過臨床試驗,至少是三期臨床試驗,在這之後,藥品才能上市。
但君實生物的是“有條件獲批上市”,根據《臨床急需藥品有條件批准上市的技術指南(徵求意見稿)》,如果有新藥能預防或治療嚴重疾病、罕見病等,即可申請有條件批准上市。
這或許是特瑞普利單抗能快速獲批上市的原因。根據回覆函內容,目前君實生物的相關臨床試驗將爭取在2021年底前完成。
哪怕上交所的問詢函中提及了自媒體所說的“領導這支團隊和這家公司的,是一對沒有任何生物學科背景的父子”,但君實生物也並未提及這對父子的情況。
目前,君實生物的控股股東、實際控制人是熊鳳祥和熊俊父子。其中,兒子熊俊擔任董事長。截至今年三季度末,熊俊持股比例為10.01%,熊鳳祥的持股比例4.71%。
紅星資本局翻閱君實生物的財報及招股書等,發現:在入局君實生物以前,這對父子倆的履歷上均沒有醫藥相關的背景。
其中,兒子熊俊曾在地方稅務局工作,並先後在某證券公司、資產管理公司、房地產公司以及基金管理公司工作過。
而熊鳳祥的工作大多與電氣有關,2007年11月後從武漢供電設計院退休。有消息稱熊鳳祥是鳳祥酒業的董事長,但君實生物公佈的履歷中並未有相關經歷,目前尚無法證實兩者關係。
11月13日,紅星資本局曾就相關問題致電君實生物證券部,其工作人員當時表示,他們正在準備回覆監管機構的問詢函。對於紅星資本局提出的問題,他們都已經記錄下來,稍後會回覆。
截至發稿,紅星資本局尚未得到任何回覆。
紅星新聞記者 楊佩雯
編輯 白兆鵬
(下載紅星新聞,報料有獎!)
轉載請超鏈接註明:頭條資訊 » 大專生確實多過博士,君實生物迴應了這些問題,卻迴避了另一問題
免責聲明
:非本網註明原創的信息,皆為程序自動獲取互聯網,目的在於傳遞更多信息,並不代表本網贊同其觀點和對其真實性負責;如此頁面有侵犯到您的權益,請給站長發送郵件,並提供相關證明(版權證明、身份證正反面、侵權鏈接),站長將在收到郵件24小時內刪除。